2017年9月15日,中国人口福利基金会、中国老年保健协会老年痴呆及相关疾病专业委员会联手卫材(中国)药业有限公司正式启动了黄手环行动”阿尔茨海默病关爱活动”。本着’关心人类健康‘的企业理念,结合中国病患的实际情况,卫材将日本老龄化社会下的治疗和照护经验引入中国。希望在”世界阿尔茨海默病日”即将来临之际,持续提升全社会对疾病的关注,通过升级贯穿认知、培训、照护的整体爱游戏app官网登录入口的解决方案,改善我国阿尔茨海默病治疗和照护不足的严峻现状。中国人口福利基金会郝林娜理事长、中国老年保健协会老年痴呆及相关疾病专业委员会主任委员王鲁宁教授、中国人民解放军总医院解恒革教授、北京大学精神卫生研究所王华丽教授、同济大学附属第十人民医院刘学源教授、温州医科大学附属第一医院何金彩教授、卫材(中国)药业有限公司董事长兼古宪生先生、总经理冯艳辉女士出席会议并演讲,嘉宾们共同启动了”阿尔茨海默病关爱活动”,见证卫材(中国)联手社会各界关爱中国病患的又一重要时刻。
自企业成立以来,卫材就立下了”关心人类健康”的志愿,并提炼hhc(human health care)理念,将其作为企业自身经营和企业公益行动准绳。”每名卫材员工的心中都将患者及其家属的利益放在首位,为提升其福祉做贡献,员工每年都要用1%的工作时间和患者在一起践行hhc,体会患者的感受和痛楚才能更好的提供服务。卫材面对全球各个国家的不同需求开展丰富的健康活动,我们在印度,泰国,菲律宾,英国,加拿大等国家开设诊所、开展义诊、患者关爱和医生教育活动;仅在印度我们就针对阿尔茨海默病患者开展千余次义诊,5年内,通过开设记忆门诊、培训相关医护人员帮助当地阿尔茨海默病诊疗人数增加了约6倍, 我们也将这样的理念带到中国。”卫材(中国)药业有限公司董事长兼古宪生先生在谈及”阿尔茨海默病关爱活动”设立初衷时表示。
《2016国际阿尔茨海默病协会报告》中指出:中国阿尔茨海默病患者人数呈现快速增长趋势, 与病患庞大基数形成鲜明对比的是治疗和照护的缺乏,少数阿尔茨海默病患者接受过规范诊断,相当比例的患者被误认为是自然老化现象而错过了最佳治疗时间,专业医疗照护资源覆盖率明显不足。 面对现状,”阿尔茨海默病关爱活动”以社区为中心建立完善的分级诊疗机制和专业的居家照护平台,通过五大切实举措全面防治阿尔茨海默病:
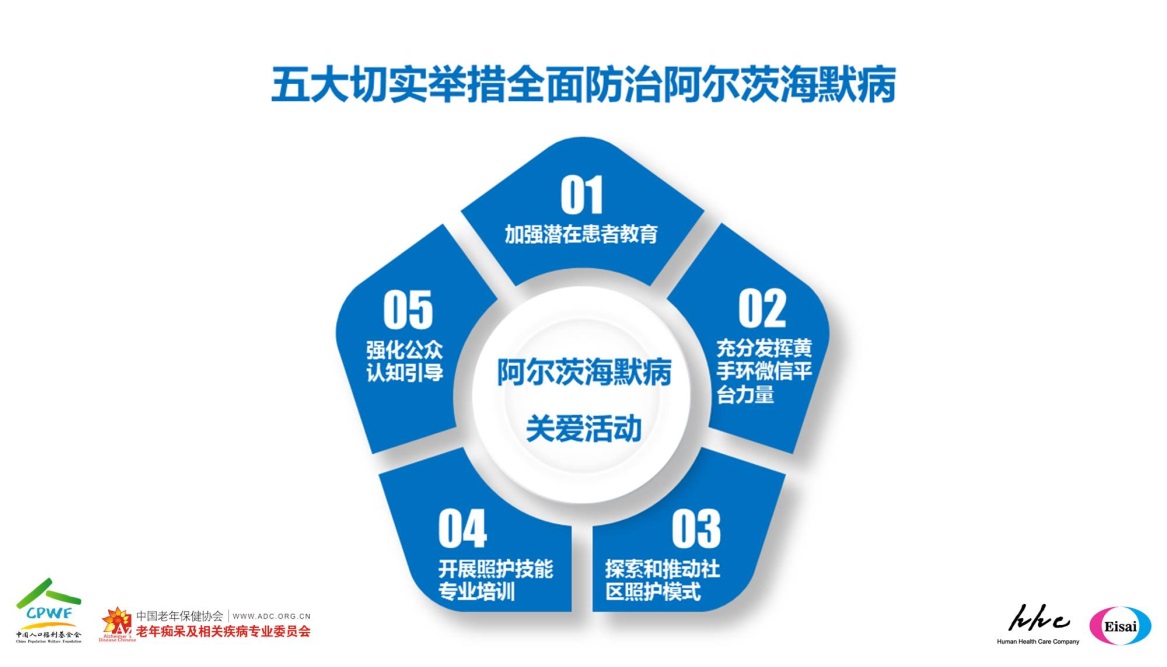
第一,加强潜在患者教育
向更多老年人发放并帮助他们更好地使用黄手环。加强黄手环的科技含量,丰富相关功能,减少老人走失风险;
第二,充分发挥黄手环微信平台力量
依托微信平台推动患病老人早诊早治,进行早期认知测试,就近推荐记忆门诊,推送照护视频,提供更好的照料方法;
第三,探索和推动社区照护模式
以社区及养老机构为中心,建立居家照护培训平台,建立宜居环境,首批计划在全国6个城市进行试点;
第四,开展照护技能专业培训
依托专家队伍,吸收国际领先的照护经验,设计并制定标准教程,对医护人员开展提高照护技能的专业培训;
第五,强化公众认知引导
开展疾病科普知识宣传教育,营造尊老、敬老、爱老、护老的社会氛围;
日本是老龄化问题严重的国家,也是老年人健康照护发达的国家,作为日本领先的制药企业,卫材将阿尔茨海默病作为长期关注的疾病领域,不仅将安理申®引入中国、推动其进入医保,还不断加大新药物研发投入。除此之外,2012年以来,卫材(中国)开始支持防患阿尔茨海默病老人走失的爱心行动”黄手环”项目,开展一系列”记得我爱你”患者关爱活动,卫材(中国)每年累计支持义诊活动超100场,累计发放黄手环24.5万个,向136个患者家庭免费赠药。”’阿尔茨海默病关爱活动‘是对以往公益行动的升级,卫材(中国)结合过去二十年深入中国家庭和社区的服务经验,联手社会各界帮助更多的患者获得早期规范治疗,以及家属对患者的照料指导。我们愿通过公益组织和学术机构把多年积累的健康管理经验带给中国患者,用阿尔茨海默病全面爱游戏app官网登录入口的解决方案守护中国人的家庭幸福。”卫材(中国)药业有限公司总经理冯艳辉女士说。
.jpg)
.jpg)